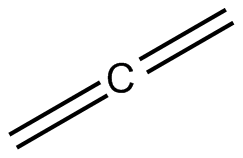
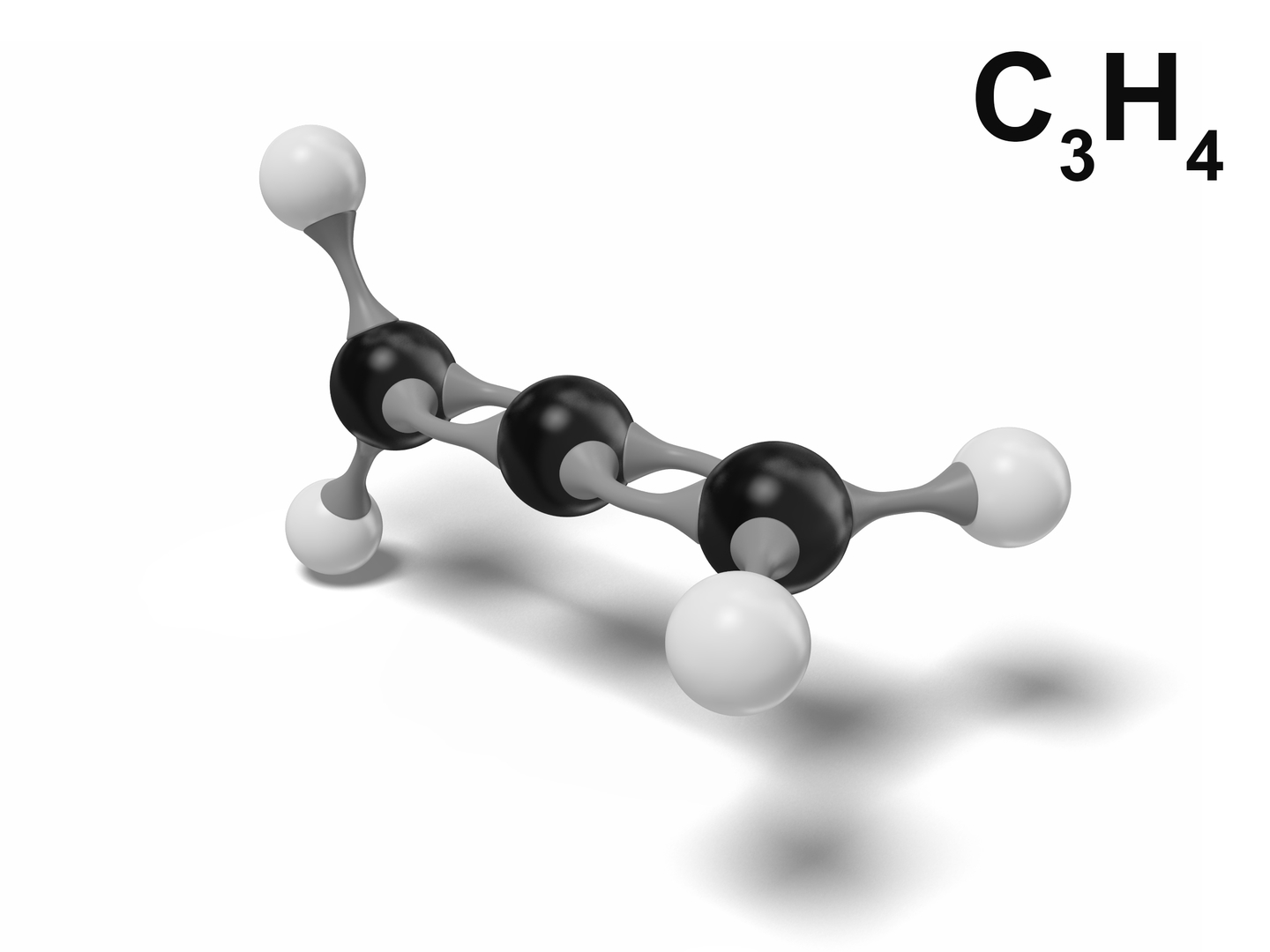
Il propadiene (detto originariamente e anche tuttora allene) è un idrocarburo che ha formula condensata CH2=C=CH2. È il più semplice diene appartenente alla classe degli alleni, caratterizzati dalla presenza di due doppi legami C-C adiacenti (cumulati), i quali alleni da esso hanno preso il nome.
Un isomero dell'allene, leggermente più stabile, è il metilacetilene (propino), uno ciclico, alquanto meno stabile è il ciclopropene.
L'allene è stato trovato nell'atmosfera di Titano (satellite di Saturno) nel 2019 e si stima che sia presente nel mezzo interstellare ma, dato che la molecola non ha momento dipolare, finora non è stato possibile rivelarlo.
Etimologia
Il nome «allene» deriva da all(il)- -ene (il suffisso tipico per designare insaturazione), nel senso di allile insaturo.
Reattività
Il propadiene si trova in equilibrio tautomerico con il propino, con un'energia di attivazione stimata di 64 kcal/mol e rispetto al quale risulta sfavorito:
Per questo equilibrio, Keq = 0,1 a 5 °C e 0,22 a 270 °C.
Proprietà e struttura molecolare
L'allene è un composto termodinamicamente instabile, la sua formazione da carbonio e idrogeno (a 25 °C) è alquanto endotermica, ΔHƒ° = 189,95 kJ/mol. È anche leggermente meno stabile del suo isomero strutturale metilacetilene (CH3−C≡CH), ΔHƒ° = 185,4 kJ/mol.
In condizioni ambiente l'allene è un gas incolore, molto infiammabile, solubile in benzene e etere di petrolio, ma praticamente insolubile in acqua.
Nella molecola, l'atomo di carbonio centrale dell'allene forma due legami σ e due legami π ed è quindi ibridato sp, per cui l'angolo con cui esso si lega ai due carboni terminali è di 180º; questi ultimi, avendo tre legami σ e un legame π, sono ibridati sp2. Pertanto, ogni gruppo CH2 è planare, ma i piani in cui giacciono questi due gruppi sono tra loro perpendicolari perché i due legami π del C centrale sono formati dai suoi due orbitali p, che formano un angolo di 90° tra di loro. La simmetria risultante della molecola è D2d.
Da indagini spettroscopiche rotazionali nella regione delle microonde è stato possibile ricavare lunghezze (r) ed angoli di legame (∠):
- r(C−H) = 108,7 pm; r(C=C) = 130,8 pm;
- ∠(HCH) = 118,2°; ∠(HCC) = 120,9°.
I legami C-H hanno lunghezza praticamente uguale al valore normale per un C(sp2)−H, che è di 108 pm. I legami C=C risultano anch'essi di lunghezza normale rispetto allo standard di C(sp)=C(sp2), che è di 131 pm, ma sono apprezzabilmente più corti che nell'etilene (133,9 pm) e la differenza è da ascrivere alla differente ibridazione del carbonio centrale, con maggior carattere s.
L'angolo HCH è leggermente più stretto del valore ideale di 120° per l'ibridazione sp2, ma il lieve restringimento si deve al fatto che il doppio legame occupa più spazio angolare rispetto a un legame semplice, come suggerito dal modello VSEPR, e si osserva anche nell'etilene, dove l'angolo HCH è di 117,6°.
Chiralità
Un allene sostituito, nel caso in cui i due sostituenti che formano ciascuna coppia siano tra loro diversi (del tipo ), è un esempio in cui è presente un asse stereogenico: gli alleni così sostituiti sono perciò molecole chirali. Se nella molecola sono presenti più doppi legami cumulati, i cumuleni risultanti possono essere chirali solo se essi sono in numero pari.
Note
Altri progetti
- Wikimedia Commons contiene immagini o altri file su propadiene